ادامه حیات در موجودات وابسته به آب است که فراوانترین ماده در بافتهای گیاهی و حیوانی و دنیای اطراف ما میباشد. بیش از 80 درصد سطح زمین را آب پوشانده است که بهصورت آب نسبتا خالص در رودخانه و دریاچهها و محلول رقیق نمک در اقیانوسها و بهصورت جامد تقریبا خالص در دشتهای برف و رودخانههای یخی و پهنههای یخی قطبی وجود دارد. خواص غیر عادی آب ، اثر عمیقی بر ماهیت محیط زیست دارد.
بالا بودن گرمای ویژه آب از تغییرات زیاد دمای سطح زمین جلوگیری میکند. حجم عظیم آب در اقیانوسها و دریاها گرمای خورشید را در طول روز جذب کرده ، بدون تغییر دمای قابل ملاحظهای آن را شب به اتمسفر بر میگردانند. در روی کره ماه که آب وجود ندارد و سطح آن صخرههایی با گرمای ویژه پایین ( یک پنجم گرمای ویژه آب ) تشکیل شده است، گستره دمایی میتواند از 150 درجه تا 120 درجه تغییر کند.
مولکول آب از یک اتم اکسیژن و دو اتم هیدروژن تشکیل شده است و دارای ساختمانی خمیده میباشد. خواص غیر عادی آب حاکی از آن است که در این مولکول یک نوع نیروی بین مولکولی قوی وجود دارد. این نیروی قوی ، جاذبه میان H از یک مولکول آب و اکسیژن از مولکول دیگر میباشد و به پیوند هیروژنی موسوم است.
اختلاف الکترونگاتیوی میان O و H به اندازه ایست که ابر الکترونی در H2O ( و مولکولهای مشابه مانند NH3 , NF ) از هیدروژن به طرف اکسیژن جابجا میشود و هیدروژن در تاثیر متقابل با مولکولهای مجاور تقریبا مانند یک پروتون عمل میکند. اندازه کوچک هیدروژن باعث میشود که اتم اکسیژن از مولکول مجاور به آن نزدیک شده ، پیوندی میان آنها ایجاد شود.
نکته مهم این است که پیوند هیدروژنی فقط بین H و اکسیژن و نیتروژن و فلوئور ایجاد میشود. خواص غیر عادی آب با پیوند هیدروژنی توجیه میشود.
بالا بودن گرمای ویژه آب نسبت به دیگر مایعات و جامدات ، نشان دهنده مقدار بالای انرژی لازم برای شکستن پیوندهای هیدروژنی آب است. تعداد پیوندهای هیدروژنی با افزایش دما کم میشود، ولی حتی تا 100 درجه ، آنقدر پیوند هیدروژنی موجود است تا باعث شود گرمای تبخیر آب در مقایسه با سایر مایعات بالاتر باشد (540cal/gr). همان گونه که اشاره شد، این خاصیت آب ، سبب شده است که آب نقش تنظیم کننده حرارتی داشته باشد و جهان را در برابر تغییرات ناگهانی دما حفظ کند.
بالا بودن گرمای تبخیر آب به مقدار زیادی باعث ثابت ماندن دمای بدن در محدوده کم میشود. مقدار زیادی از گرمای حاصل از سوخت و ساز بدن از طریق تبخیر سطحی آب از میان روزنههای پوست خارج میشود.
هنگام انجماد آب ، مولکولهای H2O در یک شش ضلعی باز قرار میگیرند. هر اتم اکسیژن در بلور یخ به 4 هیدروژن وصل میشود که با 2 اتم هیدروژن پیوند کووالانسی معمولی و با دو تای دیگر پیوند هیدروژنی تشکیل میدهد. بالا بودن نسبت فضای خالی در ساختمان یخ ، باعث کمتر شدن تراکم آن نسبت به آب میشود. افزایش حجم ، باعث کاهش چگالی آب میشود. سرد شدن آب تا زیر 4 درجه باعث کاهش تدریجی چگالی آب میشود و این نشان میدهد که در نقطه انجماد آب انتقال از یک ساختمان مولکولی فشرده و بسته به یک ساختمان باز بهطور ناگهانی صورت نمیگیرد، بلکه بهتدریج و در گستره دما انجام میشود.
با کاهش دما مولکولهای بیشتری به شکل ساختمان یخ میپیوندند و در دمای زیر 4 درجه تبدیل به ساختمان باز بر انقباض حاصل از سرد کردن غلبه کرده ، با پایین آمدن دما به سمت 0 درجه آب منبسط میشود. انبساط آب به هنگام انجماد هم اثرات مفید و هم اثرات مضری دارد. انجماد آب در بافتهای گیاهی و جانوری باعث تخریب دیواره سلولی در اثر انبساط میشود. اما همین فرایند انبساط در اثر یخ زدن آب در حفرههای سنگها و صخرهها باعث شکستن سنگها شده و ایجاد خاکهای حاصلخیز میکند.
تغییر دانسیته آب با دما که این تغییر در 4 درجه به حداکثر مقدار خود میرسد در ناحیههایی که آب و هوای زمستانی دارند اهمیت فراوانی دارد با پائین آمدن دمای هوا لایههای متراکمتر آب در سطح دریاچه به کف آن جابجا میشوند و در این فرایند گردشی اکسیژن و مواد غذایی تقریبا بطور یکنواخت به تمام قسمتهای دریاچه میرسد.
بعد از رسیدن به حالت پایدار دمای قسمت زیرین آب به 4 درجه میرسد و باعث میشود تا جانوران آبزی در زمستان به زندگی خود ادامه دهند. از طرف دیگر کم بودن دانسیته یخ نسبت به آب باعث شناور شدن یخ در سطح آب میشود. اگر یخ سنگینتر از آب بود آب کف دریاها و رودخانهها یکپارچه منجمد میشد و عواقب خطرناکی برای آبزیان در پی داشت.
پیوند هیدروژنی بین مولکولهای آب باعث تشکیل غشای نسبتا محکمی در سطح آن مینمایند که در نتیجه باعث میشود که یک سوزن یا تیغ بر روی آب بماند یا برخی حشرات در سطح آب راه روند همچنین این خاصیت باعث بالا رفتن آب از لولههای موئین میشود. کشش سطحی آب با افزایش دما به دلیل کم شدن پیوندهای هیدروژنی کاهش مییابد.
|
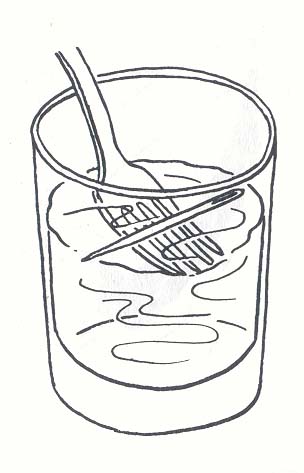
سوزن در سطح آب شناور می ماند .
سوزن از مقدار آبی که می تواند جا به جا کند سنگینتر است و انتظار می رود در آب فرو رود . اما وجود یک پوسته نامرئی کشسان سوزن را شناور نگه می دارد . وقتی آب با هوا سطح مشترک پیدا می کنند ، تمام مولکولهای سطحی آب به همدیگر متصل شده لایه بسیار نازک پیوسته و پوست مانندی را بوجود می آورد .
2 . داخل ظرفی که سوزن روی سطح آن شناور است یک تکه صابون فرو کنید .
سوزن فوراً پایین می رود .
صابون کشش سطحی را کاهش می دهد .
یکی از دلایلی که ما از صابون برای شستشو استفاده می کنیم ، همین است . با کاهش کشش سطحی ، آب صابون می تواند سطوح روغنی و چرب را خیس کند .
اگر نیروهای ما بین مولکولی مایع کمتر از نیروی متقابل بین مایع و یک جسم جامد باشد مایع در سطح جامد پخش میشود که خاصیت تر کنندگی نام دارد. ایجاد سطح مقعر بر آب موجود در لولههای نازک با توجه به پدیده تر کردن توجیه میشود. خاصیت تر کنندگی آب باعث استفاده از آن در شستشو میشود. دمای بالا و شویندهها خاصیت تر کنندگی آب را بالا میبرند.
قطبیت آب به دلیل اختلاف الکترونگاتیوی بین اتمهای اکسیژن و هیدروژن میباشد.
آب به دلیل ثابت دیالکتریک بالا و همچنین داشتن قطبیت ترکیبات یونی را در خود حل میکند. ثابت دیالکتریک بالای آب باعث کاهش نیروی جاذبه میان یونها میشود. در نتیجه احتمال ترکیب مجدد آنها و خارج شدن به صورت رسوب را کم میکند. آب از معدود مایعاتی است که میتواند در دمای اتاق مقدار زیادی از ترکیبات یونی را در خود حل کند. همچنین آب مواد مولکولی مانند متانول ، آمونیاک ، اوره و … را که می توانند با آب پیوند هیدروژنی برقرار کنند هم در خود حل میکند.
منبع: دانشنامه رشد